Sunkiųjų metalų jonų pašalinimas iš nuotekų.
Sunkiųjų metalų šalinimas šarminiais reagentais
Sunkiųjų metalų jonai iš nuotekų šalinami pervedant jonus į mažai tirpius junginius (hidroksidus arba bazinius karbonatus) tam tikslui nuotekos neutralizuojamos įvairiais šarminiais reagentais (kalcio, natrio, magnio hidroksidais, kalcio oksidu, natrio, kalcio, magnio karbonatais). Lentelėje 3.1 pateikiamos metalų hidroksidų iškritimo į nuosėdas pH reikšmės ir liekamosios sunkiųjų metalų jonų koncentracijos nuotekose.
Kai rūgščios nuotekos neutralizuojamos kalkių pienu, kuriame yra nemaža dalis kalcio karbonato, arba sodos tirpalais, kai kurių sunkiųjų metalų jonai (pvz. cinkas, varis ir kt.) nusėda bazinių karbonatų pavidalu. Jie yra mažiau tirpūs vandenyje nei atitinkami hidroksidai. Todėl susidarant baziniams karbonatams sunkiųjų metalų jonų perėjimas į netirpius junginius vyksta pilniau. Be to, daugumos metalų baziniai karbonatai pradeda nusėsti esant žymiai mažesnėms pH reikšmėms, nei atitinkami hidroksidai.
Praktiškai pastebėta, kad kartu nusodinant kelių sunkiųjų metalų hidroksidus, esant tai pačiai pH reikšmei, gaunami geresni rezultatai nei nusodinant kiekvieną metalą atskirai.
Nusodinimo pagreitinimui naudojamas flokuliantas – poliakrilamidas (0,1% tirpalas).
Lentelė 1.1
Metalų hidroksidų iškritimo į nuosėdas pH reikšmės ir liekamosios sunkiųjų metalų jonų koncentracijos
| Hidroksido formulė | Išsėdimo pradžios pH, kai nusodinamo jono pradinė koncentracija 0,01M | Visiško išsodinimo pH (likutinė koncentracija mažesnė nei 10-5M) | Nuosėdų tirpimo pradžios pH | Likutinė metalo jono koncentracija praktiškai, kai pH 8,5-9,0, mg/l |
| Fe(OH)2 | 7,5 | 9,7 | 13,5 | 0,3 – 1,0 |
| Fe(OH)3 | 2,3 | 4,1 | 14,0 | 0,3 – 0,5 |
| Zn(OH)2 | 6,4 | 8,0 | 10,5 | 0,1 – 0,05 |
| Cr(OH)3 | 4,9 | 6,8 | 12,0 | 0,1 – 0,05 |
| Ni(OH)2 | 7,7 | 9,5-10,0 | – | 0,25 – 0,75 |
| Al(OH)3 | 4,0 | 5,2 | 7,8 | 0,1 – 0,5 |
| Cd(OH)2 | 8,2 | 9,7-10,5 | – | 2,5 |
| Cu(OH)2 | 5,5 | 8,0-10,0 | – | 0,1 – 0,15 |
| Mn(OH)2 | 8,8 | 10,4 | 14,0 | 1,8 – 2,0 |
Nuosėdų drėgnumas po nusodintuvų 98 – 99,5%. Nuosėdų drėgnumui sumažinti rekomenduojamas papildomas nusistovėjimas dumblo sutankintuve 3 – 5 paras. Tuomet dumblo drėgnumas 65 – 97%. Po to dumblas paduodamas į nusausinimo mazgą (vakuuminį filtrą, filtrpresą, centrifugą). Nuosėdų drėgnumas po vakuuminio filtro 80 – 85%, po centrifugos – 72 – 79%, po filtrpreso – 65 – 70%.
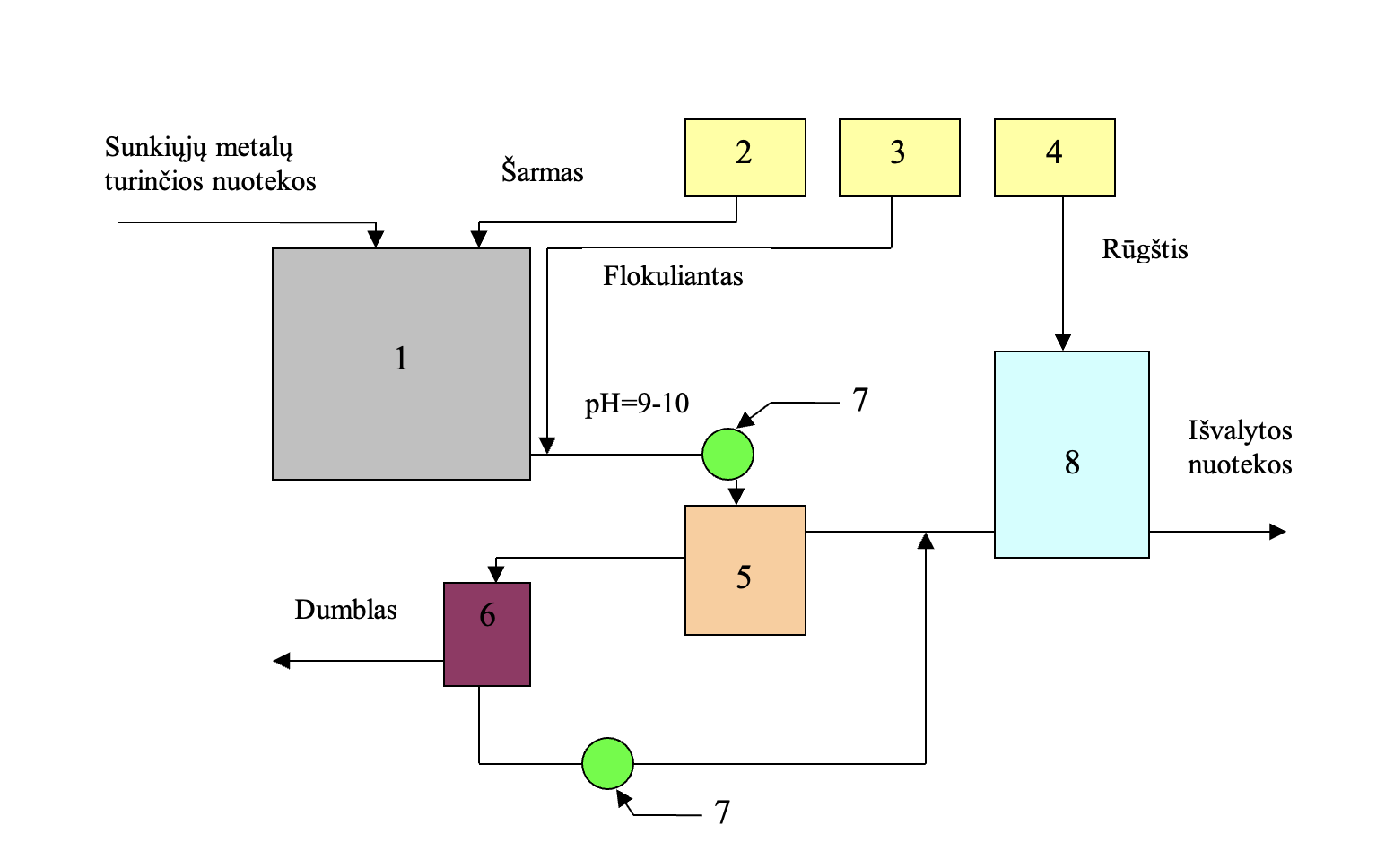
Pav. 1.1 Sunkiųjų metalų šalinimo iš nuotekų reagentinio valymo principinė schema:
1 – reaktorius- rūgštinių-šarminių nuotekų neutralizatorius, 2 – šarmo dozatorius
3 – flokulianto dozatorius, 4 – rūgšties dozatorius, 5 – nusodintuvas
6 – mechaninis filtras, 7 – siurblys, 8 – išvalytų nuotekų neutralizatorius.
Sunkiųjų metalų valymas feritiniu (feritizacijos) metodu
Feritinis (feritizacijos) metodas – reagentinio metodo modifikacija, kai sunkieji metalai iš nuotekų pašalinami geležies turinčiais reagentais.
Geležis, VIII grupės šalutinio pogrupio elementas pasižymi cheminiu aktyvumu, turi polinkį sudaryti alotropines modifikacijas ir dalyvauti erdviniuose faziniuose virsmuose. Geležis sudaro daugybę junginių, kaip stechiometrinės sudėties, taip ir bertolidinio pobūdžio (nestechiometrinius kintamos sudėties binarinius junginius). Pastarieji ir nulemia geležies turinčių reagentų koaguliacinį ir adsorbcinį veikimą.
Nuotekų valymas feritiniu metodu paremtas tuo, kad magnetiniai geležies hidroksidai absorbuoja priemaišas (tame tarpe ir sunkiųjų metalų jonus) sudarydami feritus, ir toliau vykstančia topochemine absorbuotų medžiagų sulaikymo reakcija ferito kristalinėje gardelėje. Feritas – tai hipotetinės geležies rūgšties HFeO2 dariniai, kuriuose vandenilio jonas pakeistas metalų jonais.
Pagrindinis reagentas – geležies (II) sulfato heptahidratas FeSO4·7H2O – atlieka, susidaranti titano dioksido gamyboje arba ėsdinant plieną.
Į geležies sulfato tirpalą pridėjus šarmo, pradedant nuo pH 7,7 susidaro gelsvai baltos dribsnių pavidalo nuosėdos. Veikiant orui jos įgauna rudą atspalvį, kurį nulemia susidaręs aduktas (skirtingų molekulių junginys, kuriame atomų jungimosi tvarka išlieka nepakitusi) Fe(OH)2·Fe(OH)3. Jis ypatingai aktyvus, priklausomai nuo tirpalo sudėties, pH ir temperatūros gali virsti tokiais junginiais:
paramgnetiniu metahidroksidu FeO(OH) su mineralo hetito struktūra;
feromagnetiniu metahidroksidu FeO(OH) su mineralo lepidokrokito struktūra;
neferomagnetiniu metahidroksidu FeO(OH);
juodai-rudu magnetitu Fe3O4;
feromagnetiniu raudonai-rudu polihidratu Fe2O3·nH2O.
Išvardinti junginiai, susidarydami ir individualiai, ir mišinyje, atspindi jų susidarymo reakcijų sudėtingumą. Esant mažoms geležies koncentracijoms plačiame pH diapazone susidaro junginiai su ryškiomis magnetinėmis savybėmis. Geležies koncentracijai didėjant, didėja reikalavimai pH, kuriam esant feritizacijos procesai vyksta optimaliai: susidaro geležies magnetito-ferito FeII(FeIIIO2) užuomazgos pagal reakciją:
Fe(OH)3‑ + 2Fe(OH)4‑ → Fe3O4 + 4H2O + 3OH‑,
arba bendruoju pavidalu:
FeSO4 + 12NaOH + O2 → 2Fe3O4 + 6H2O + 6Na2SO4,
o taip pat susidaro spalvotųjų metalų feritai MFe2O4:
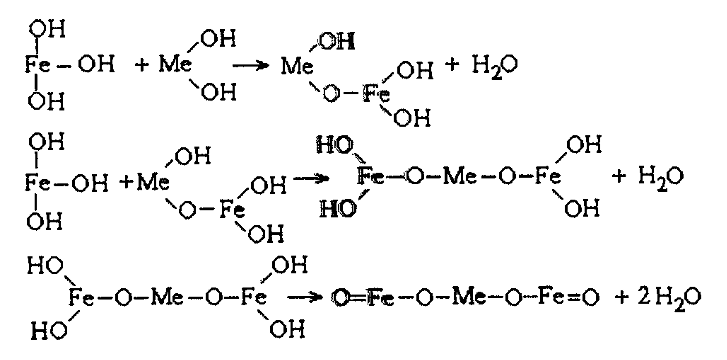
Metalų gebėjimas bendrai iškristi į nuosėdas su geležies metahidroksidu ir sudaryti feritus stiprėja eilėje Cd < Zn < Co < Ni < Cu. Kadmis ir cinkas yra mažai aktyvūs feromagnetinių kompozicijų susidaryme ir mažiausiai sulaikomi. Išvalymo laipsnis, kai nuotekose yra kelių metalų jonai, didesnis lyginant su pavienius metalus turinčiomis nuotekomis. Taip pat jis didesnis esant didesnei pH reikšmei.
Pagrindiniai feritinio metodo privalumai:
galimybė vienu metu vienoje stadijoje pašalinti įvairių sunkiųjų metalų jonus;
sunkiųjų metalų jonai klatruojami (sulaikomi) kristalinių, neišplaunamų produktų pavidalu;
kartu su ištirpusiais metalais iš nuotekų pašalinamos disperguotos suspensijos ir emulguoti teršalai.
procesas nejautrus kitų druskų poveikiui, jos gali būti netgi didelėmis koncentracijomis.
Šaltiniai:
- С.С. Виноградов. Экологически безопасное гальваническое производство. М. «Глобус» 1998.
- Гальванические покрытия в машиностроении. Справочник. Т.2, М. «Машиностроение» 1985.
- „Forbedret rensning af tungmetalholdigt spildevand“, Miljø-Kemi Dansk Miljøcenter, 1991



